13656039165
新冠肺炎疫情暴發(fā),安徽安慶、銅陵不少縣城,遍布口罩生產(chǎn)企業(yè),其中很多企業(yè)單一家的口罩機就達40臺,每天的出貨量達到近300萬個(包括N95),每天2班倒,一班員工就達1000人左右,小小的縣城因幾十家口罩廠的日夜加班趕貨,頓時成為不夜城。他們生產(chǎn)的口罩,除了滿足內(nèi)需后,肯定還出口全球各地。
由于美國國內(nèi)的防疫物資緊張且短缺,老美也向中國進口口罩,目前不少中國企業(yè)生產(chǎn)的口罩已獲得美國FDA的緊急使用授權(quán)。那么出口到到美國的口罩要符合什么認證標準和資質(zhì)呢?
一、美國的口罩分類
美國根據(jù)預期用途,將口罩分為醫(yī)用外科口罩(Surgical Masks)和N95呼吸口罩(N95 Respirators),并進行不同的監(jiān)管。其中,醫(yī)用外科口罩被歸屬為醫(yī)療器械類別,需要經(jīng)過FDA注冊;N95呼吸口罩歸屬為個人防護設備,需要經(jīng)過美國國家職業(yè)安全健康研究所(NOISH)認證,具體認證由NOISH下屬的美國國家個人防護技術(shù)實驗室(NPPTL)實施。
醫(yī)用外科口罩采用的標準為21 CFR 878.4040,可標記為手術(shù)口罩、隔離口罩、牙科口罩或醫(yī)療口罩。
我們常說的N95不是特定的產(chǎn)品名稱,“95”是指在NIOSH規(guī)定的檢測條件下,過濾效率達到95%。只要符合這個標準的口罩,且通過NIOSH審查的口罩就可以稱為“N95型口罩”。按照42 CFR Part 84,根據(jù)防護顆粒類型、防護顆粒時間,NIOSH將其認證的呼吸防護口罩分為N、R、P三個系列。
N系列 | N代表Not resistant to oil,該系列口罩可防護非油性懸浮顆粒且無時限。 |
R系列 | R代表Resistant to oil,該系列口罩可防護非油性懸浮顆粒及汗油性懸浮顆粒,使用時間不超過八小時。 |
P系列 | P代表oil Proof,該系列口罩可防護非油性懸浮顆粒及汗油性懸浮顆粒且無時限。 |
有些顆粒物的載體是有油性時,而這些物質(zhì)附在靜電無紡布上會降低電性,使細小粉塵穿透,因此對于防含油氣溶膠的濾料要經(jīng)過特殊的靜電處理,以達到防細小粉塵的目的。根據(jù)呼吸口罩的最低粒子過濾效率,N、R、P每個系列又劃分出了3個等級,組合起來就包括N100、N99、N95、R100、R99、R95、P100、P99、P95,共9類。
100等級 | 表示最低粒子過濾效率為99.97%。 |
99等級 | 表示最低粒子過濾效率為99%。 |
95等級 | 表示最低粒子過濾效率為95%。 |
二、美國醫(yī)療器械監(jiān)管分類
類別 | 監(jiān)管程度 | 具體要求 |
I類醫(yī)療器械 (Class I) | 一般監(jiān)管 | 機構(gòu)注冊與產(chǎn)品登記、質(zhì)量體系(QS)要求(部分I類器械可GMP豁免)、標簽要求 |
II類醫(yī)療器械 (Class II) | 一般監(jiān)管;特殊控制;大部分II類醫(yī)療器械須提交510(k),小部分可豁免 | 除需滿足I類器械的一般監(jiān)管要求外,還須符合FDA所規(guī)定的特殊要求或標準,如特定產(chǎn)品的強制性性能要求、特殊標識要求等。 |
III類醫(yī)療器械 (Class III) | 一般監(jiān)管;上市前許可PMA;部分III類器械在證明實質(zhì)等同性的情況下可申請PMA豁免,僅提交510(k) | 除需滿足I類器械的一般監(jiān)管要求外,申請PMA的器械必須滿足嚴格的性能、標簽標準以及實驗室與臨床試驗要求。 |
510(k)為上市前公告(Pre-market Notification),旨在證明產(chǎn)品與已經(jīng)合法上市的產(chǎn)品實質(zhì)性的等同。
PMA為上市前審批(Pre-market Approval),旨在提供足夠、有效的證據(jù)證明醫(yī)療器械按照設計和生產(chǎn)的預期用途,能夠確保產(chǎn)品的安全有效。 | ||
三、美國對醫(yī)療口罩的監(jiān)管等級及監(jiān)管要求
各類不同口罩的監(jiān)管類別及提交要求不一樣。可進入FDA網(wǎng)站:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPCD/classification.cfm
用關(guān)鍵詞“mask”進行查詢,了解各類不同口罩所屬的監(jiān)管類別及監(jiān)管要求。
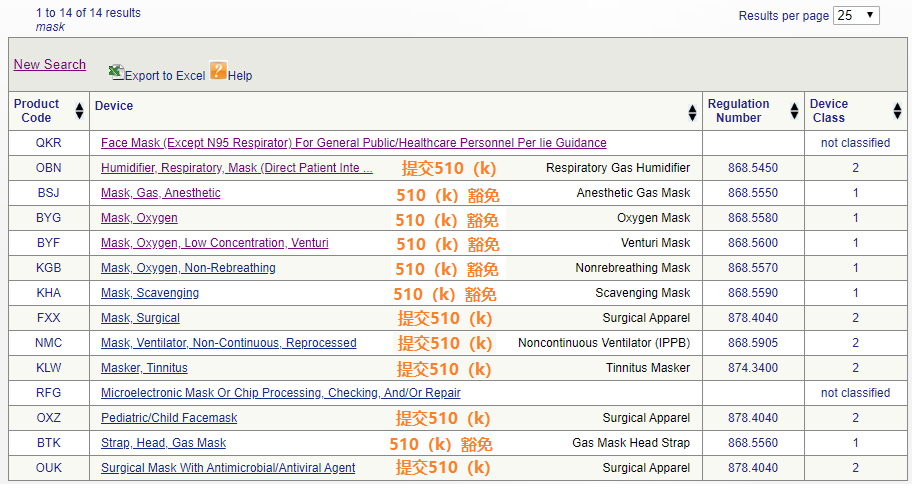
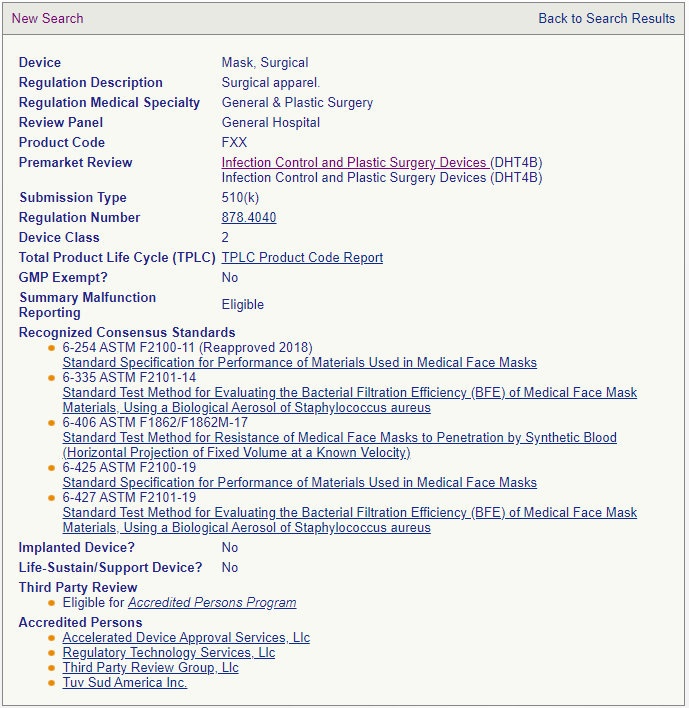
以外科口罩為例,其產(chǎn)品編碼為FXX,監(jiān)管分類為2類,需要提交510(k),其認可的符合性標準包括ASTM F2100-11、ASTM F2101-14、ASTM F1862/F1862M-17、ASTM F2100-19、ASTM F2101-19。(參見下圖)
四、美國口罩相關(guān)標準規(guī)范
標準號 | 標準名稱 |
ASTMF1862/F1862M-2017 | 醫(yī)用口罩抗人工合成血滲透的標準試驗方法(已知速度下固定體積的水平投影) |
ASTMF2100-2019 | 醫(yī)用口罩材料性能標準規(guī)范 |
ASTMF2101-2019 | 用金黃色葡萄球菌生物氣溶膠評價醫(yī)用口罩材料的細菌過濾效率(BFE)的標準試驗方法 |
ASTMF2299/F2299M-2003(2017) | 用膠乳球測定醫(yī)用面具材料粒子滲透性初始效率的標準試驗方法 |
42 CFR Part 84 | 呼吸防護裝置 |
42 CFR part 878.4040 | 醫(yī)用口罩 |
五、美國對醫(yī)用口罩性能的要求
美國醫(yī)用口罩主要采用的標準為ASTM F2100-2019,從細菌過濾率、微粒子過濾率、壓力差、合成血液穿透阻力、阻燃等幾個方面對醫(yī)用口罩的性能進行了規(guī)定。具體性能指標要求如下:
特性 | 低度阻隔 | 中度阻隔 | 高度阻隔 | 測試標準 |
細菌過濾效率(BFE) | ≧95% | ≧98% | ≧98% | ASTM F2101:2019 |
微粒子過濾效率(PFE) | ≧95% | ≧98% | ≧98% | EN 146830:219 |
壓力差(mmH2O/cm2) | <5.0 | <6.0 | <6.0 | ASTM F2299/F2299M:2003(2017) |
合成血液穿透阻力 | 80mmHg | 120mmHg | 160mmHg | ASTM F1862/F1862M:2017 |
阻燃 | 1級 | 1級 | 1級 | 16 CFR part 1610 |



